ХЕМОТАКСИС ПРОСТЕЙШИХ В ОТНОШЕНИИ ФИТОНЦИДОВ
Б. П. Токин
Лаборатории обшей биологии и фитонцидов (зав. — проф. Б. П. Токин)
Института экспериментальной медицины АМН СССР, Ленинград
В литературе неоднократно подчеркивалось, что фитонциды могут играть иммунологическую роль в жизни растения.
Однако выделяющиеся во внешнюю среду фитонциды (например, при ранении растения) убивают микроорганизмы не всегда «молниеносно», в первые секунды, как это имеет место в опытах in vitro со многими растениями, обладающими мощными фитонцидными свойствами.
Летучие фитонциды и фитонцидные тканевые соки могут тормозить размножение бактерий и низших грибов, создавать химические условия, препятствующие другим организмам усваивать питательные вещества, могут снижать темпы размножения тех или иных микроорганизмов. Растение может, например, продуцировать во внешнюю среду фитонциды, стимулирующие размножение тех микроорганизмов, которые являются антагонистами в отношении патогенных для данного растения форм микробов. Фитонциды, несомненно, являются фактором, влияющим на состав растительных и животных ассоциации.
Мы высказали предположение, что одним из возможных «механизмов» защитного действия фитонцидов является хемотаксис подвижных форм бактерий, зооспор грибов, одноклеточных животных организмов, а также предположение о том, что летучие фитонциды наземных растений могут «отпугивать» или «привлекать» тех или иных насекомых и другие организмы.
Нам казалось особенно интересным проверить правильность этого предположения в отношении водных растений.
Явление отрицательного фитонцидотаксиса, наряду со многими другими факторами, вероятно, может иметь иммунологическое значение и для наземных растений.
В случае ранения растений насекомыми, действием ветра, дождя и т. д. выделяются летучие фракции фитонцидов, подчас большой бактерицидной, фунгицидной и протистоцидной мощности, и они, по удачному выражению Б. М. Козо-Полянского, оказываются «первой линией обороны» растения против микроорганизмов, могущих попасть в район ранения из воздуха, воды или почвы (в случае ранений подземных частей растения).
Но можно представить себе и другие соотношения. Достаточно, например, чтобы в тех микропространствах воды, в которых оказались подвижные микроорганизмы, было вызвано явление отрицательного хемотаксиса, препятствующего хотя бы на очень короткое время непосредственному контакту паразита с клетками растения в районе ранения. Затем могут вступить в действие и другие иммунологические механизмы физиологического и анатомического порядка. Это тем более легко себе представить, если учесть, что подчас ничтожные концентрации тех или иных веществ могут вызвать отчетливою картину хемотаксиса.
Нам удалось доказать явления фитонцидотаксиса простейших и разработать методику, при помощи которой явление хемотаксиса обнаруживается в столь яркой форме, что его легко может воспроизводить каждый экспериментатор.
Описанные многими авторами и считающиеся совершенно безупречными методики, вероятно, оказались все же не настолько совершенными, чтобы их можно было использовать для точных исследований в области фитонцидов. Вспомним, например, опыты, в которых капля исследуемого на хемотаксис вещества подводится под покровное стекло со слоем жидкости с теми или иными подвижными микроорганизмами; укажем также на метод Пфеффера: запаянный с одного конца капилляр, наполненный исследуемой жидкостью, вносится открытым концом в каплю воды, содержащую бактерии; под микроскопом изучается, в какую сторону будут двигаться бактерии — навстречу или против «диффузионного тока». Эти и подобные способы несовершенны во многих отношениях, так как примешиваются посторонние неустранимые явления, например диффузионные токи и возникающие «микроволны» жидкостей. Нетрудно ошибиться в толковании явлений, если принять во внимание исключительную чувствительность простейших и бактерий к механическим раздражениям. Конечно, явление хемотаксиса можно изучать и этими старыми методами, как и поступали сотрудники нашей лаборатории.
Обратимся к экспериментам. Работая с инфузориями, мы обратили внимание на одно весьма интересное явление: при поднесении источника фитонцидов (измельченного тем или иным способом растения) к капле жидкости с инфузориями последние в очень короткий срок меняют свое движение на «обратное», т. е. движутся не передним концом, а задним.
Проведем следующий опыт. На дно солонки (диаметр 3,5 см, глубина 0,5 см) помещается 0,1 г (или значительно меньшее количество) только что срезанной бритвой и измельченной «кожуры» зрелого плода лимона (поверхностный слой клеток). Солонку покрывают стеклом, в центре внутренней поверхности которого помещают висячую каплю сенного отвара с инфузорией—глаукомой (Glaucoma scintillans). Под микроскопом видно, как в первые же доли секунды движение всех глауком становится «обратным». Будем наблюдать в течение минуты. Если источник фитонцидов не чрезмерно мощный и если инфузории остаются живыми, все они в течение этой минуты движутся задним концом вперед, вращаясь вокруг длинной оси и производя одновременно «воронкообразные» движения. Если стекло с висячей каплей снять с солонки, то через 1—4 минуты все глаукомы снова начинают двигаться нормально, передним концом. Приблизив снова каплю с простейшими к источнику фитонцидов, отмечаем, что через минуту абсолютно все глаукомы опять меняют свое движение на «обратное». Стоит опять удалить висячую каплю от источника фитонцидов, как вскоре движения всех инфузории становятся нормальными — передним концом вперед. Мы повторяли это до 10 раз. Время смены движения инфузорий на «обратное» и возвращения к нормальному движению зависит от количества фитонцидной кашицы, от величины висячей капли, от объема сосуда, в котором ставится опыт, от температуры и т. п. Если количество фитонцидной кашицы достаточно большое, например 0,1 г «кожуры» плода лимона на объем описанной солонки, а висячая капля мала, то смена движения инфузорий на «обратное» и возвращение к нормальному происходит с поразительной быстротой — моментально, в доли секунды.
Можно различным способом варьировать эти опыты в зависимости от задачи эксперимента.
Для интересующихся быстротой реакция ресничного аппарата мы рекомендуем провести следующий опыт. Установить висячую каплю сенного отвара с глаукомами над источником фитонцидов, вызывающим «обратное» движение инфузорий. Когда все особи начнут двигаться передним концом назад, прибавить как можно быстрее к капле сенного отвара каплю водопроводной воды, — движение всех особей моментально станет нормальным.
Из этих опытов видно, что в данных конкретных условиях факторы механического порядка (резкое изменение состояния воды и капли сенного отвара при соединении их и т. п.) могут не приниматься в расчет. Ясно, что дело заключается именно в действии химических веществ.
В связи с описанными опытами с летучими фитонцидами цитрусовых возник вопрос, не происходит ли смена движения простейших на «обратное» под влиянием тех или иных токсических для них веществ, т. е. не является ли она проявлением отрицательного хемотаксиса. Необходимо принять во внимание, пары фитонцидов действуют одновременно на всю поверхность капли жидкости с простейшими и, в зависимости от быстроты их растворения и диффузии, капля с инфузориями во всех своих частях будет подвергаться действию фитонцидов. Инфузория реагирует на повреждающее воздействие отрицательным хемотаксисом так же, как она реагировала бы в случае иного пространственного расположения раздражителя, ибо инфузория, конечно, реагирует только так, как ей свойственно, т. е. как это выработалось в результате эволюции, если, конечно, явление хемотаксиса имеет какое-либо приспособительное значение.
В связи с вышеописанными опытами возникает, конечно, много вопросов, которых мы здесь не касаемся.
Мы столкнулись далеко не с единичными случаями, когда заведомо протистоцидные летучие фитонциды не вызывают у инфузорий смены движения на «обратное». Так, при воздействии летучих фракций фитонцидов луковиц лука движение глауком до момента полной остановки происходило передним концом (детали не описываем, отметим лишь, что нередко происходит «кружение» на месте; инфузория как бы упирается задним концом в одну точку и меняет положение переднего конца так, что описывает всем телом «конус», «воронку»).
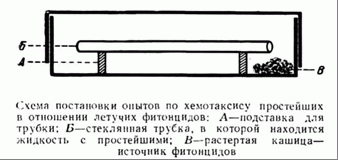
Несомненно, более значительный интерес для теории фитонцидов могут представлять опыты с хемотаксисом, излагаемые ниже.
Берут чашку Петри любого размера (см. рисунок). На подставки (А) кладут стеклянную трубку (Б) той или иной длины, любого диаметра. Трубка с одной стороны запаяна, с другой — открыта. Ее наполняют сенным отваром или иной жидкостью с испытуемыми на хемотаксис простейшими.
Мы работали с глаукомой, причем обычно брали такую «концентрацию» глауком, чтобы в поле зрения было не меньше 10—20 экземпляров. Для удобства наблюдения под микроскопом необходимо делать подставки достаточно высокими, с таким расчетом, чтобы положенные на них трубки почти соприкасались с внутренней поверхностью крышки. Еще удобнее вести наблюдения, если вместо цилиндрической трубки взять призматическую.
На дно такой смонтированной для опыта чашки Петри кладут источник фитонцидов, например измельченные листья черемухи, лавровишни и т. п. В зависимости от мощности источника фитонцидов, от степени растворения и диффузии выделяющихся летучих фракций фитонцидов в сенном отваре, от места расположения источника (лучшее расположение показано на рисунке — В) и других условий, с той или иной быстротой обнаруживается очень интересное явление: инфузории, совершая, казалось бы, беспорядочные движения, начинают уплывать от источника раздражения, т. е. от открытого конца трубки к закрытому.
При удачных сочетаниях условий результаты подобных опытов исключительно демонстративны. Можно добиться, чтобы вследствие отрицательного хемотаксиса под влиянием летучих фракций фитонцидов уже в течение 30 секунд на расстоянии 2—3 мм от открытого конца не оказалось ни одной инфузории: все они уплывают по направлению к закрытому концу трубки.
Какова интенсивность раздражимости протоплазмы инфузорий и насколько интенсивна работа ресничного аппарата?
Если принять длину инфузории в 100 µ, то через 30 секунд эта инфузория окажется на расстоянии 2 мм от мениска жидкости и уплывет в сторону закрытого конца трубки. Таким образом, если бы инфузория двигалась по прямой линии от источника раздражения, то за 30 секунд она проплыла бы расстояние в 20 раз больше ее длины. Но эту цифру нужно умножить во много раз (минимум в 10), так как инфузория движется не по прямой линии от источника раздражения, а делает многочисленные и причудливые зигзаги.
Мы провели десятки опытов с летучими фитонцидами разных растений: листьев черемухи, весенних и осенних почек этого растения, «кожуры» лимона, мандарина, апельсина, листьев клена, дуба, самшита, эвкалиптовых, игл хвойных, листьев и корневища манника (Clyceria aquatica Whlb.), луковицы лука, разных органов других растений.
Все опыты дали положительный результат.
Приведем иллюстрации.
1. Опыт от 30.IV.1949 г. Источник летучих фитонцидов — листья клена.
Аппаратура: чашка Петри диаметром 10 см, высотой 1,1 см. Длина трубки, в которой находится сенной отвар с глаукомами, 6,5 см; внутренний диаметр трубки 3 мм. В чашку Петри помещается 2 г измельченных, только что сорванных листьев клена. Чашка закрывается. Наблюдение ведется под микроскопом. Сочетание окуляра и объектива таково, что каждое поле зрения равно 2¼ мм.
Результаты опыта. Первое поле зрения (отсчитываемое от мениска жидкости у открытого конца трубки) «очистилось» от инфузорий через 1 минуту; второе поле зрения — через 2 минуты от начала опыта. Через 9 часов у открытого конца трубки в первых 21/4 мм нет ни одной инфузории, в следующем поле зрения (т. е. в дальнейших 2¼ мм) 15-20 особей, а в остальном пространстве трубки везде приблизительно одинаковая концентрация инфузорий (около 50 в каждом поле зрения).
Прошли сутки. Чашку не открывали. Источник фитонцидов не сменяли. Слабо выраженный накануне отрицательный хемотаксис сменился положительным.
В четырех аналогичных опытах результаты почти одинаковые.
Приводим «диаграмму» концентраций инфузорий через 3 суток. Двумя горизонтальными линиями изображается трубка, в которой находится сенной отвар с глаукомами. Левый конец закрытый, правый открытый. Представим себе, что трубка состоит из 13 одинаковых частей. Участок между двумя вертикальными линиями соответствует 0,5 см (длина всей трубки 6,5 см). Между каждыми двумя чертами проставлены цифры — число инфузорий в данном участке, равном 0,5 см. Регистрируется число инфузорий не в объеме данного участка, а лишь число их в данной плоскости (фокусное расстояние не меняется).
| 0 | 2 | 2 | 30 | 20 | 30 | 40 | 60 | 100 | несколько сот | несколько сот | ∞ | ∞ |
В первых двух участках у открытого конца (обозначенных знаком ∞) — несосчитываемое количество, а в участках, ближайших к закрытому концу, или совсем нет инфузорий, или встречаются лишь единичные особи.
II. Опыт от 19. V 1949 г. Источник летучих фитонцидов — листья черемухи обыкновенной.
Техника опытов та же, что и в предыдущем примере с кленом.
Результаты опыта. Первое поле зрения «очистилось» от глауком через 4 минуты; второе — через 9 минут от начала опыта. Через 1 час 30 минут «очистилось» 33/4 полей зрения, через 9 часов — 61/2 полей зрения (т. е. около 15 мм длины трубки). В следующих полях зрения встречается по 10-15 особей; число их увеличивается по мере приближения к закрытому концу, так что вблизи закрытого конца оказывается трудно сосчитываемое количество.
III. Источник летучих фитонцидов — листья эвкалипта (Eucalyptus cinerea).
В течение 30 минут «очистилась» от инфузорий зона в 0,5 см. Отчетливо выраженный отрицательный хемотаксис через 4 часа сменяется положительным (к измененным летучим фитонцидам или к кислороду воздуха?) Через сутки оказалось, что на расстоянии около 1 см от мениска жидкости (т. е. от открытого конца) сосредоточено абсолютное большинство инфузорий, затем идет зона (также примерно в 1 см) густой взвеси. Эта зона большой концентрации инфузорий постепенно сменяется зонами все более низкой концентрации, так что на расстоянии 1 см от закрытого конца можно видеть всего 2—3 особи.
Если источник летучих фитонцидов очень мощен и взято большое количество только что измельченного растительного материала, то наряду с отчетливо выраженным отрицательным хемотаксисом можно наблюдать через те или иные промежутки времени гибель инфузорий. В этом, конечно, нет ничего удивительного, так как общеизвестна исключительная протистоцидная мощность ряда растений. В этой связи приведем пример опытов с лавровишней.
IV. Взято 2,5 г только что измельченных листьев лавровишни. Через 30 минут на расстоянии 0,5 см от открытого конца не видно ни одной инфузории, а еще через 0,5 см — 10 плавающих инфузорий в поле зрения; на расстоянии около 2 см начинается зона, в которой в каждом поле зрения насчитывается более 100 особей.
Через 6 часов на протяжении 3 см от открытого конца не видно плавающих инфузорий; кроме того, на стенке трубки, особенно «на дне», оказывается большое количество мертвых инфузорий. Оставшиеся живые инфузории сильно изменены, «кеглеобразны», перистомальная выемка «распрямилась», протоплазма потемнела, более отчетливо видны вакуоли, на переднем конце заметно скопление темной зернистости.
Еще через несколько часов все инфузории погибают, причем мертвые глаукомы могут сохраняться месяцами; возможно, гнилостные бактерии не находят в них питательного субстрата или адсорбированные мертвыми инфузориями фитонциды оказывают токсическое воздействие на микробы.
Можно ускорить все описанные явления, если вместо стеклянной трубки с одним открытым концом взять трубку, у которой оба конца открыты, и наполнить ее всю сенным отваром с испытуемыми инфузориями.
В первое время можно наблюдать явление отрицательного хемотаксиса на обоих открытых концах трубки: «концентрация» инфузорий является максимальной в срединной части трубки. Через некоторое время все инфузории погибают.
Мы пытались выяснить, имеет ли значение в опытах по фитонцидотаксису величина внутреннего диаметра трубки. В опытах с листьями лавровишни как источником фитонцидов диаметр трубок был следующий: 1; 1,5 и 3,5 мм. Оказалось, что в первые минуты быстрота движения инфузорий от источника фитонцидов в разных трубках различна. Так, в трубке с внутренним диаметром в 3,5 мм пространство в 2,5 мм очищалось через 6 минут, а в трубке диаметром в 1 мм то же пространство очистилось через 3 минуты и, наконец, в трубке с внутренним диаметром в 1,5 мм за 4 минуты инфузории уплыли на расстояние 4,5 мм от открытого конца. Через 4 часа мы снова определяли концентрацию инфузорий в тех же трубках и убедились в отсутствии каких-либо различий в трубках разных калибров.
Обратим внимание читателя на два явления. При действии летучих фракций фитонцидов на висячую каплю сенного отвара с глаукомами последние немедленно изменяют движение на «обратное». Однако при тех же источниках фитонцидов (например, измельченная «кожура» лимона) в опытах по хемотаксису с использованием описанной методики (опыты с трубками в чашке Петри) не удается увидеть «обратного» движения: глаукомы поворачиваются и продолжают плыть передним концом.
Напрашивается мысль о том, что только при определенных концентрациях токсического начала инфузория «реагирует обратным движением».
Другое явление — смена отрицательного хемотаксиса на положительный.
Приведем весьма демонстративный пример. В одном опыте были использованы еще не распустившиеся почки черемухи [Padus racemosa (Lam.) Gilib], (сорванные 5. IV.). Техника опытов изображена на вышеприведенном рисунке.
В первую же минуту было отмечено явление отрицательного хемотаксиса глауком: они уплывали от открытого конца трубки, и так создавалось свободное пространство. Через 30 минут свободное от инфузорий пространство равнялось уже 1 см. Прошли сутки. Часть инфузорий погибла, но большинство оставались живыми. Вместо ясно выраженного отрицательного хемотаксиса через сутки наблюдалась столь же ясно выраженная картина положительного хемотаксиса.
Все инфузории оказались у открытого конца трубки в пространстве в 1 см, остальная часть трубки (5,5 см) совершенно свободна от инфузорий. У открытого конца столь густая взвесь инфузорий, что под микроскопом не удается даже приблизительно сосчитать их количество в одном поле зрения. Еще через сутки инфузории оказались равномерно распределенными по всей длине трубки. Наблюдения в последующие 3 дня не дали чего-либо нового.
Объяснить смену всех этих явлений мы пока не можем. Выскажем лишь предположения.
1. Фитонциды почек черемухи в этот период не столь мощны, чтобы в данных условиях опыта убить все глаукомы в достаточно большом слое сенного отвара. Летучие фракции фитонцидов поступают в жидкость и вызывают явление отрицательного хемотаксиса. Они диффундируют все больше в сторону закрытого конца трубки.
2. В первые же часы летучие фракции фитонцидов оказались во всех участках столба жидкости. Наибольшая их концентрация — у открытого конца трубки, так как в трубку поступают новые и новые порции летучих фракций фитонцидов.
3. Наступает, однако, момент, когда продуцирование фитонцидов растительной кашицей прекращается. У открытого конца трубки вследствие лучшей аэрации сенной отвар имеет наименьшую концентрацию токсических веществ, вызывающих явление отрицательного хемотаксиса. Заплывающие в это пространство инфузории почти не подвергаются токсическим воздействиям, идущим со стороны открытого конца. Наоборот, некоторое токсическое действие инфузории испытывают с противоположной стороны и, может быть, в порядке отрицательного хемотаксиса плывут в сторону открытого конца (возможно, однако, что в данном случае правильнее предположить положительный хемотаксис инфузорий в отношении кислорода). Таким образом, продвижение инфузорий к закрытому концу трубки в начале опыта и обратное движение их впоследствии, как это ни парадоксально на первый взгляд, может быть вызвано одними и теми же веществами.
4. Вскоре полностью прекращается продуцирование летучих фракций фитонцидов. Постепенно и в трубке исчезают токсические вещества. Все приходит в норму, и взвесь инфузорий по всей длине трубки становится более или менее равномерной.
Можно полагать, однако, что через несколько часов измельченные листья уже не только не продуцируют токсических веществ, вызывающих явление отрицательного хемотаксиса, но начинают выделять парообразные вещества, вызывающие явление положительного хемотаксиса.
Разработанная нами методика обнаружения хемотаксиса простейших в отношении летучих фракций фитонцидов может быть, вероятно, с успехом применена в различных исследовательских направлениях (выяснение механизма явления хемотаксиса, определение скорости диффузии различных летучих фитонцидов и т. д.).
Нам удалось использовать эту методику для определения интенсивности фитонцидных свойств растений при различном их физиологическом состоянии, в разные периоды вегетации и т. д.
Мы убедились на ряде контрольных опытов, что этот способ весьма чувствителен и точен. Допустим, сравнивается протистоцидная сила фитонцидов двух источников. Ставим опыты по хемотаксису описанным здесь способом. Одновременно другой исследователь сравнивает протистоцидные свойства фитонцидов тех же источников при тех же температурных и иных условиях, но иным способом, обычно принятым в нашей лаборатории: определенная навеска растительной кашицы помещается на дно чашки Петри, а на крышку чашки или на предметное стекло, установленное в чашке, наносится капля сенного отвара с инфузориями. Регистрируется скорость умирания последних. Оказалось, что в многочисленных параллельных опытах по хемотаксису и определению скорости гибели инфузорий (проведенных с разными растениями, в разное время года и т. д.) получается поразительное совпадение результатов, а именно, чем энергичнее протистоцидные свойства исследуемых фитонцидов, тем ярче картина отрицательного хемотаксиса. В дальнейшем мы приведем некоторые примеры, которые убедят читателя в правильности этих утверждений.
Мы ставили опыты с целью выяснить следующие вопросы.
1. Где больше фитонцидов — в нераспустившихся или распустившихся почках обыкновенной черемухи, сорванной весной с одной и той же ветки.
2. Какие листья лавровишни обладают более мощными протистоцидными свойствами — молодые или старые.
3. Одинаков ли фитонцидный эффект в случае, если источником фитонцидов являются листья черемухи, собранные днем и ночью.
4. Какие иглы пихты выделяют более мощные фитонциды — «молодые» или «старые».
5. Одинаково ли продуцирование летучих фитонцидов листьями и корневищем манника.
6. Где больше содержится летучих фитонцидов — в основании или вершине листьев дуба.
7. Одинаковы ли фитонцидные свойства листьев Р. racemosa, Р. virginiana и Р. Maackii.
8. Какова мощность фитонцидов осенних листьев и почек обыкновенной черемухи.
Во всех этих и иных экспериментах, результаты которых сообщаются в специальной работе, мы убедились в большой ценности описанной методики обнаружения явления отрицательного хемотаксиса.
Мы ограничиваемся здесь приведением отдельных примеров.
Молодой и старый лист лавровишни
В 1944 г. из Сухуми были припечены в Ленинградский ботанический сад черенки в 20 см и высажены в оранжерейных условиях.
На второй год их высадили в грунт, отепляя зимой, где они и пробыли до осени 1948 г., когда были доставлены в нашу лабораторию.
Высота куста к моменту опыта 120 см. Крона развита хорошо. На кусте 343 старых листа (прошлых лет) и 22 молодых листа — менее чем полугодового возраста, отличающиеся от старых более прозрачной листовой пластинкой и яркозеленым цветом верхней стороны.
Для опыта срывали одновременно старые и молодые листья приблизительно одинаковых размеров. Те и другие разрезали (отдельно) на мелкие кусочки. Одинаковые навески молодых и старых листьев — по 2 г — растирали в ступке; полученную растертую кашицу помещали в чашку Петри, в которой находились стеклянные трубки с сенным отваром и инфузориями (глаукомами).
Техника опытов показана на вышеприведенном рисунке. Напомним, что длина трубки 6,5 см, а внутренний диаметр 3 мм. Каждое поле зрения (при рассматривании под микроскопом) равно 2,5 см.
Результаты опытов представлены в табл. 1.
Таблица 1
Результаты опытов по хемотаксису инфузорий в отношении летучих фитонцидов старых и молодых листьев лавровишни
| Поле зрения | Время очищения от инфузорий (в мин.) | |
| Источник фитонцидов | ||
| Старые листья | Молодые листья | |
| Первое | 8 | 10 |
| Второе | 60 | 20 |
| Третье | 95 | 45 |
Через 7 часов очистилось: 1,5 см 3,5 см (от начала открытого конца трубки)
Не остается, таким образом, сомнений в большей фитонцидной активности молодых листьев. Мы не описываем здесь многочисленных подробностей, касающихся морфологии инфузорий. Укажем лишь, что в первые же часы инфузории под влиянием фитонцидов изменяют свою форму: они становятся «кеглеобразными», удлиняются; перистомальная впадина «сглаживается», инфузория темнеет, передний конец густо «набит» мелкими зернышками.
Одновременно ставились опыты «по убиению» глауком (той же культуры, того же клона).
Опыты ставились сотрудником нашей лаборатории на часовых стеклах.
На внутреннюю поверхность верхнего покрывающего стекла наносили висячую каплю сенного отвара с глаукомами (в капле около 100 особей). На дно нижнего часового стекла помещали только что полученную путем растирания в ступке растительную кашицу (из молодых или старых листьев). Навеска: 1 г на 7,5 см3 воздушного пространства. Регистрировали гибель инфузорий (полная остановка движения и посмертное округление).
Результаты опытов представлены в табл. 2.
Таблица 2
Результаты испытания протистоцидной активности летучих фитонцидов старых и молодых листьев лавровишни
| Источник фитонцидов | |||
| молодые листья | старые листья | ||
| время остановки движения (в мин.) | время наступления округления (в мин.) | время остановки движения (в мин.) | время наступления округления (в мин.) |
| 5 1/2 | 11 | 10 1/2 | 15 |
| 7 | 11 | 10 | 14 |
| 6 | 9 | 11 | 15 |
| 8 | 11 1/2 | 11 1/2 | 12 1/2 |
| 6 | 9 1/2 | 10 | 13 1/2 |
| 5 1/2 | 10 | 12 | 15 1/2 |
| 7 1/2 | 10 1/2 | 11 | 14 |
| 6 | 9 | 10 | 13 1/2 |
| 6 | 10 | 9 | 13 |
| 5 | 9 | 10 | 13 |
| Среднее 6 1/2 | 10 | 10 1/2 | 14 |
Как видим, эти материалы полностью соответствуют данным, полученным в опытах по хемотаксису. Здесь также фитонцидная активность молодых листьев примерно в 2 раза больше, чем у старых листьев.
Завязь плода и лист черемухи обыкновенной
Опыт ставился 25. V 1949 г.
Техника опытов в точности соответствует технике предыдущих опытов.
Завязь плодов и листья брались с одной и той же ветки.
Результаты опытов приведены в табл. 3.
Таблица 3
Результаты опытов по хемотаксису инфузорий в отношении летучих фитонцидов завязи плодов и листьев черемухи обыкновенной
| Поле зрения | Источник фитонцидов | |
| Завязь плодов | Листья | |
| Время очищения от инфузорий (в мин.) | ||
| Первое | 10 1/2 | 5 |
| Второе | 23 | 12 1/2 |
| Через 2 часа 30 мин. очистилось | 5 полей зрения | 7 полей зрения |
| Через 9 час. 30 мин. очистилось | 7 » » | 9 » » |
Результаты испытаний протистоцидных свойств. Смерть глауком при воздействии фитонцидов листьев наступает через 10 минут (учитывалась одна из стадий умирания — предсмертное округление), а при воздействии фитонцидов завязи плода — через 211/2 минуты.
Таким образом, можно отметить полную однотипность полученных результатов в опытах по хемотаксису и в опытах по исследованию протистоцидных свойств фитонцидов тех же источников.
Очевидно, что отрицательный хемотаксис вызывается теми же веществами, которые обладают протистоцидными свойствами.
Молодая и старая хвоя пихты, сорванная с одной и той же ветки 31. V 1949 г.
Техника опытов та же, что и в предыдущих опытах.
Результаты опытов по хемотаксису представлены в табл. 4.
Таблица 4
Результаты опытов по хемотаксису инфузорий в отношении летучих фитонцидов молодой и старой хвои пихты
| Поле зрения | Источник фитонцидов | |
| Старая хвоя | Молодая хвоя | |
| Время очищения от инфузорий (в мин.) | ||
| Первое | 20 | 10 |
| Второе | 27 1/2 | 25 |
| Через 5 час. очистилось | 1,75 поля зрения | 3,5 поля зрения |
| Через 9 час. очистилось | На всем протяжении трубки одинаковая концентрация инфузорий | По-прежнему 3,5 поля зрения свободно от инфузорий |
Как видим, явление отрицательного хемотаксиса значительно более выражено в опыте со старой хвоей.
С этим прекрасно согласуются результаты опытов, проведенных одновременно другими исследователями с тем же растительным материалом. Среднее время (результаты 10 повторных опытов) гибели глауком при воздействии фитонцидов старой хвои 71/2 минут, а молодой хвои 14 минут. Соответственное время остановки движения глауком 41/2 и 91/2 минут.
Основание и вершина листа дуба (Quercusrobur L.)
Опыты ставились 24. VI 1949 г. В течение почти 2 недель до этого стояла холодная дождливая погода (ночью температура 11°, днем 15—19°). В день опытов — дождь, днем 8°.
В целях большей демонстративности опытов срединную часть листа дуба вырезали полоской и для эксперимента использовали прилежащую к черешку часть листовой пластины, а в другом, параллельно поставленном опыте — вершину листа. Техника опытов была та же, что и в предыдущих опытах.
Результаты опытов по хемотаксису. Нам не удалось обнаружить каких-либо существенных различий между действием фитонцидов основания и вершины листа. Первое поле зрения очистилось в обоих случаях через 30 минут, а второе — лишь в течение более часа, причем опять-таки в обоих случаях мы не обнаружили каких-либо различий.
Через 9 часов после начала опытов мы попытались сосчитать количество плавающих инфузорий в каждом поле зрения, постепенно передвигая под микроскопом опытную трубку.
Через сутки мы также сделали соответствующие подсчеты.
Приводим полученные данные (схемы 1, 2, 3, 4).
Схемы означают трубку, разделенную на 13 частей так, что каждый квадратик схематического рисунка трубки соответствует 0,5 см.
Цифры в каждом квадратике означают число инфузорий, видимых на протяжении 0,5 см под микроскопом. На схеме 1 приведены данные о количестве инфузорий в каждом квадрате через 9 часов после начала опыта с вершиной листа; схема 2 — результаты опытов с основанием листа (также через 9 часов); схемы 3 и 4 дают соответственно представление о концентрации инфузорий на протяжении трубок через сутки, причем на схеме 3 приведены результаты опытов с вершиной листа, а на схеме 4 — с основанием листа.
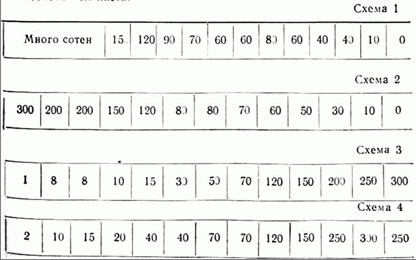
Приведенные цифры позволяют сделать заключение, что в случае воздействия фитонцидами вершины и основания листа мы получаем одинаковую картину отрицательного хемотаксиса (в первые часы, включая и 9-й час) и сменяющего его впоследствии положительного хемотаксиса (схемы 3 и 4 — результат просмотра через сутки).
Как и в предыдущих аналогичных опытах, другой исследователь, независимо от нас, используя описанную выше методику, ставил опыты (работая с часовыми стеклами), исследуя протистоцидные свойства фитонцидов основания и вершины листьев.
Результаты опытов приведены в табл. 5.
Таблица 5
Результаты испытания протистоцидной активности фитонцидов вершины и основания листьев дуба
|
Источник фитонцидов |
|
|
Вершина листа |
Основание листья |
|
Время наступления гибели инфузорий (в мин.) |
|
|
7 |
7 |
|
5,5 |
5,5 |
|
6 |
7 |
|
5 |
5,5 |
|
6 |
6 |
|
7 |
6,5 |
|
6,5 |
7 |
|
5,5 |
5 |
|
Среднее 6 |
Среднее 6 |
Таким образом, и в опытах с протистоцидным действием листьев дуба мы видим полный параллелизм между результатами исследования явления фитонцидотаксиса простейших и протистоцидных свойств летучих фракций фитонцидов.
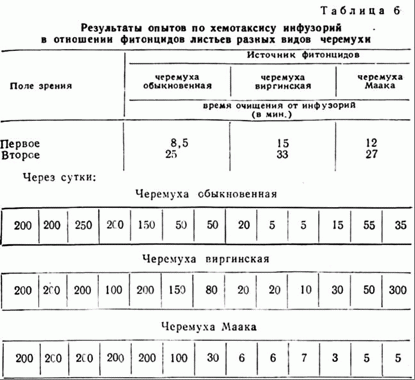
Фитонцидные свойства листьев черемухи обыкновенной (P. recemosa), виргинской (P. Virginina) и Маака (P. Maackii)
Опыты ставились 8. IX 1949 г.
Результаты опытов по хемотаксису представлены в табл. 6.
Испытание протистоцидных свойств с использованием описанной методики работы с часовыми стеклами показало, что протистоцидные свойства летучих фитонцидов листьев виргинской черемухи наиболее мощны (инфузории умирают в среднем через минуту после начала воздействия); на втором месте стоит черемуха маакии (гибель инфузорий наступает в среднем через 3 минуты); наконец, на последнем месте — черемуха обыкновенная.
В этих опытах нет того эффектного параллелизма в результатах, который мы наблюдали обычно при исследовании явления хемотаксиса и протистоцидных свойств одного и того же источника. Воздержимся пока от попыток объяснения этого исключения. Одно несомненно — ошибок технического порядка быть не могло. Напрашивается мысль о том, что летучие фракции фитонцидов листьев разных видов черемухи представляют не одно какое-либо вещество, а комплекс веществ, и что, помимо «хемотаксических» и одновременно протистоцидных веществ, имеются компоненты, действующие только протистоцидно или вызывающие только явления хемотаксиса, но не убивающие простейших.
Приведем данные еще одной серии опытов.
Фитонцидные свойства осенних листьев и почек черемухи обыкновенной
Опыты ставились 29. IX 1949.
За неделю до опыта стояла теплая сухая погода. Температура днем доходила до 18—20°, ночью —9—11°.
Почки и листья взяты с одного дерева в одно и то же время. Большинство листьев его пожелтевшие. Именно эти пожелтевшие листья и брались для опытов.
Результаты опытов по хемотаксису представлены в табл. 7.
Таблица 7
Результаты опытов по хемотаксису инфузорий в отношении фитонцидов осенних листьев и почек черемухи обыкновенной
|
Поле зрения |
Источник фитонцидов |
|
|
Почки |
Листья |
|
|
Время очищения от инфузорий (в мин.) |
||
|
Первое |
6,5 |
22,5 |
|
Второе |
35 |
Через 2 часа поле зрения еще не очистилось |
В трубках, бывших в атмосфере летучих фитонцидов почек черемухи, через сутки все инфузории оказались мертвыми. В трубках же, бывших в атмосфере фитонцидов листьев, через сутки форма инфузорий не изменилась, движения их были обычные; распределение по длине трубки совершенно равномерно (в каждом поле зрения около 10 особей).
Результаты опытов по изучению протистоцидных свойств фитонцидов, проведенных одновременно другим экспериментатором, также говорят о мощных фитонцидных свойствах летучих фракций фитонцидов осенних почек и об очень ослабленной фитонцидной активности осенних пожелтевших листьев. Фитонциды осенних почек убивали инфузории в среднем через 81/2 минут, а фитонциды листьев — через 1 час 40 минут, т. е. фитонцидная активность последних приблизительно в 12 раз слабее.
Мы не останавливались в этой статье на биологическом значении обнаруженных явлений. Этому посвящена специальная работа.
Нет никаких оснований, конечно, рассматривать все описанные факты обязательно в эколого-эволюционной плоскости и каждый частный случай положительного или отрицательного хемотаксиса связывать с явлением иммунитета растений. Это очевидно уже потому, что известно много случаев хемотаксиса, не укладывающихся в схему адаптивного характера явлений раздражимости. Например, туфелька или стентор движутся задним концом вперед в растворе солей калия; его же соли привлекают к себе хламидомонад и других жгутиконосцев.
Но явление таксиса простейших в отношении фитонцидов должно учитываться при дальнейшей разработке проблемы фитонцидов. Вероятно, аналогичные явления удастся наблюдать и в опытах с подвижными формами бактерий, зооспор грибов и т. д. Этими вопросами в настоящее время занята наша лаборатория.